Introduction
La culture de protoplastes, de cellules, de tissus ou
d’organes végétaux loin de leur environnement naturel ou normal, dans des
conditions artificielles, est connue sous le nom de culture tissulaire. Il est
également connu sous le nom in vitro (In vitro est un mot latin, il signifie
que - en verre ou en éprouvette) la croissance de protoplastes, de cellules, de
tissus et d’organes végétaux. Une seule explante peut être multipliée en
plusieurs milliers de plantes en peu de temps et d’espace dans des conditions
contrôlées.
Les techniques de culture tissulaire sont souvent
utilisées pour la production commerciale de plantes ainsi que pour la recherche
sur les plantes. La culture de tissus végétaux est un outil indispensable pour
la régénération des plantes transgéniques. En dehors de cela, certaines des
principales applications de la culture de tissus végétaux sont la propagation
clonale de variétés d’élite, la conservation de plantes menacées, la production
de plantes exemptes de virus, la préservation du matériel génétique, la
production industrielle de métabolites secondaires. etc., Dans ce chapitre,
discutons de l’histoire, des techniques, des types, des applications de la
culture de tissus végétaux et sensibilisons aux questions éthiques.
Haberlandt (1902)
cellules végétales cultivées dans des conditions artificielles appelées in vitro (verre intérieur) dans un milieu de culture (solution saline de Knop) contenant du glucose et de la peptone et développé un cal (croissance non organisée de cellules et de tissus) et a proposé le concept de totipotence, cela signifie le développement de la plante entière à partir de cellules ou tissus isolés dans des conditions in vitro.
PRWhite (1934)
développé des cultures de racines, utilisé la solution de Knop avec trois vitamines comme la pyridoxine, la thiamine et l'acide nicotinique
Commissaire du FC (1948)
utilisé de l'eau de coco dans des travaux de culture de tissus végétaux et obtenu une prolifération cellulaire à partir d'explants de carotte (totipotence cellulaire).
Morel et Martin (1952, 1955)
développé des plantes de dahlia et de pomme de terre exemptes de virus en utilisant la culture de méristèmes de pousses.
Murashige et Skoog (1962)
milieu de culture tissulaire formulé, une référence dans la culture de tissus végétaux et c'est le milieu le plus fréquemment utilisé pour toutes sortes de travaux de culture tissulaire.
Kanta et al. (1962)
produit une fertilisation en éprouvette chez les plantes à fleurs.
Yamada et al. (1963)
a produit des cals et des cellules libres dans une culture tissulaire de Tradescantia reflexa.
Guha et Maheshwari (1964)
développé la production in vitro d'embryons haploïdes à partir d'anthères de Datura.
Vasil et Hildbrandt (1965)
ont réalisé la différenciation des plants de tabac à partir de cellules isolées uniques en micropropagation.
Takebé et al. (1971)
plants de tabac régénérés à partir de protoplastes de mésophylle isolés.
Carlson
et ses collègues ont obtenu une fusion de protoplastes entre Nicotiana glauca et Nicotiana longsdorffii et ont développé le premier hybride somatique interspécifique en 1971.
Melchers et collaborateurs en 1978
développé un hybride intergénique entre la pomme de terre et la tomate appelé pomato.
Chilton (1983)
produit des plants de tabac transformés à partir de la transformation d'une seule cellule et de l'insertion de gènes.
Horsh et al. (1984)
développé du tabac transgénique par transfert de gène médié par Agrobacterium.
Solution de Knop : Solution nutritive utilisée dans les expériences de croissance de plantes qui contient :
Nitrate de calcium 3,0 g
Nitrate de potassium 1,0 g
Saccharose 50,0 g (optimal)
Sulfate de magnésium 1,0 g
Phosphate de potassium dibasique 1,0 g
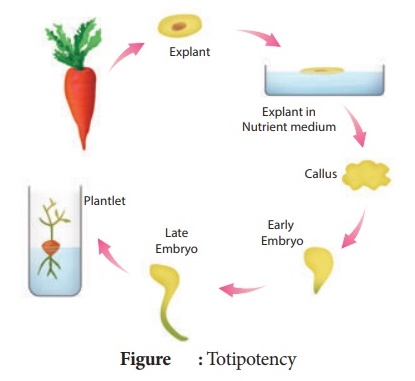
Totipotence
Propriété des cellules végétales vivantes d'avoir le potentiel génétique lorsqu'elles sont cultivées dans un milieu nutritif pour donner naissance à une plante individuelle complète.
Différenciation
Le processus de changements biochimiques et structurels par lequel les cellules se spécialisent dans la forme et la fonction.
Redifférenciation
La différenciation ultérieure d'une cellule déjà différenciée en un autre type de cellule. Par exemple, lorsque les cellules constitutives du cal ont la capacité de former une plante entière dans un milieu nutritif, le phénomène est appelé redifférenciation.
Dédifférenciation
Le phénomène de retour des cellules matures à l'état méristématique conduisant à la formation de cals est appelé dédifférenciation. Ces deux phénomènes de redifférenciation et de dédifférenciation sont les capacités inhérentes aux cellules ou tissus végétaux vivants. C'est ce qu'on appelle la totipotence.
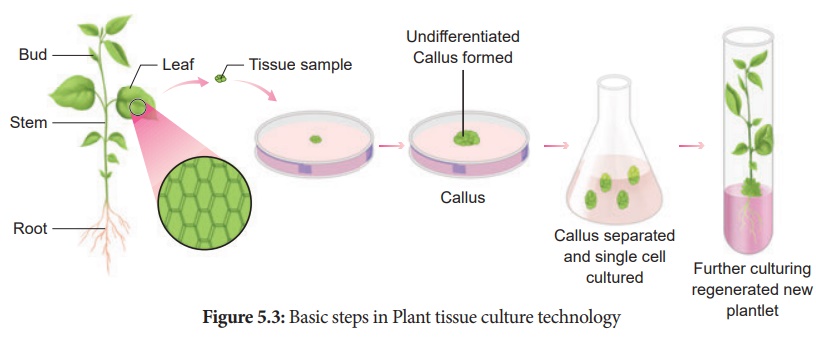
La culture de tissus végétaux
La culture de tissus végétaux est utilisée pour décrire la croissance in vitro et aseptique de toute partie de plante sur un milieu de culture tissulaire. Cette technologie repose sur trois principes fondamentaux :
• La partie de plante ou l'expiant doit être sélectionné et isolé du reste du corps de la plante.
• L'expiant doit être maintenu dans des conditions physiques (environnementales) et chimiquement définies (milieu nutritif) contrôlées.
Explant : Le tissu prélevé sur une plante sélectionnée transféré dans un milieu de culture souvent pour établir une nouvelle plante.
1. Installations de laboratoire pour PTC
Pour le PTC, le laboratoire doit disposer des installations suivantes :
· Installation de lavage pour la verrerie et fours pour le séchage de la verrerie.
· Salle de préparation du milieu avec autoclave, balance électronique et pH-mètre.
· Salle stérile de la zone de transfert avec banc à flux d'air laminaire et une unité de ventilation à pression positive appelée filtre à particules à haute efficacité (HEPA) pour maintenir des conditions aseptiques.
· Installation de culture : Cultiver l'explant inoculé dans des tubes de culture à 22-28° C avec un éclairage de lumière 2400 lux, avec une photopériode de 8-16 heures et une humidité relative d'environ 60 %.
2. Technique impliquée dans le PTC
1. Stérilisation :
La stérilisation est la technique utilisée pour se débarrasser des microbes tels que les bactéries et les champignons dans le milieu de culture, les récipients et les explants.
je. Maintien de l'environnement aseptique : Pendant la culture tissulaire in vitro, le maintien des conditions environnementales aseptiques doit être suivi, c'est-à-dire la stérilisation de la verrerie, des pinces, des scalpels et de tous les accessoires dans la stérilisation à la vapeur humide par autoclavage à 15 psi (121 °C) pendant 15 à 30 minutes ou trempage dans de l'éthanol à 70 % suivi d'un flambage et d'un refroidissement.
ii. Stérilisation de la salle de culture : Le sol et les murs sont d'abord lavés avec un détergent puis avec de l'hypochlorite de sodium à 2 % ou de l'éthanol à 95 %. L'enceinte à flux d'air laminaire est stérilisée en nettoyant le plan de travail avec de l'éthanol à 95 % puis en l'exposant à un rayonnement UV pendant 15 minutes.
iii. Stérilisation des milieux nutritifs : les milieux de culture sont distribués dans des récipients en verre, bouchés avec du coton non absorbant ou scellés avec des fermetures en plastique, puis stérilisés à l'aide d'un autoclave à 15 psi (121 °C) pendant 15 à 30 minutes. Les extraits de plantes, les vitamines, les acides aminés et les hormones sont stérilisés en passant à travers un filtre Millipore avec un diamètre de pores de 0,2 mm, puis ajoutés au milieu de culture stérilisé à l'intérieur de la chambre à flux d'air laminaire dans des conditions stériles.
iv. Stérilisation des explants : les matériaux végétaux à utiliser pour la culture tissulaire doivent être stérilisés en surface en exposant d'abord le matériau dans l'eau courante du robinet, puis en le traitant dans des agents de stérilisation de surface tels que 0,1 % de chlorure mercurique, 70 % d'éthanol dans des conditions aseptiques à l'intérieur de l'air laminaire. Chambre d'écoulement.
2. Préparation des médias
Le succès de la culture tissulaire réside dans la composition du milieu de croissance, des régulateurs de croissance des plantes et des conditions de culture telles que la température, le pH, la lumière et l'humidité. Aucun milieu n'est capable de maintenir une croissance optimale de tous les tissus végétaux. Un milieu nutritif approprié selon le principe de la culture tissulaire est préparé et utilisé.
Le milieu nutritif MS (Murashige et Skoog 1962) est couramment utilisé. Il a des sources de carbone, avec des vitamines et des hormones appropriées. Les formulations de milieux disponibles pour la culture de tissus végétaux autres que MS sont le milieu B5 (Gamborg et al 1968), le milieu White (white 1943), le milieu de Nitsch (Nitsch & Nitsch 1969). Un milieu peut être solide ou semi-solide ou liquide. Pour la solidification, un agent gélifiant tel que l'agar est ajouté.
Gélose : Un polysaccharide mucilagineux complexe obtenu à partir d'algues marines (algues marines) utilisé comme agent de solidification dans la préparation des milieux.
Composition du milieu MS (Murashige et Skoog)
Macronutriments :
Nitrate d'ammonium (NH 4 NO 3 ) 1650,0 mg/l
Nitrate de potassium (KNO 3 ) 1900,0 mg/l
Chlorure de calcium (CaCl 2 2H 2 O) 440,0 mg/l
Sulfate de magnésium (MgSO 4 6H 2 O) 370,0 mg/l
Phosphate monopotassique (KH2PO4) 170,0 mg/l
Micronutriments :
Sulfate de manganèse (MnSO 4 4H 2 O) 22,3 mg/l
Sulfate de zinc (ZnSO 4 4H 2 O) 8,6 mg/l
Acide borique (H 3 BO 3 ) 6,2 mg/l
Iodure de potassium (KI) 0,83 mg/l
Nutriment mineur :
Molybdate de sodium (Na 2 MO 4 2H 2 O) 0,250 mg/l
Sulfate cuivrique (CuSO 4 5H 2 O) 0,025 mg/l
Chlorure de cobalt (CoCl 2 6H 2 O) 0,025 mg/l
Stock de fer
Na EDTA 37,25 mg/l
Sulfate ferreux (FeSO 4 7H 2 O) 27,85 mg/l
Vitamines
Glycine 2,0 mg/l
Acide nicotinique 0,5 mg/l
Pyridoxine HCl 0,5 mg/l
Thaïamine HCl 0,1 mg/l
Hormones de croissance
IAA 1,30 mg/l
Kinétine 0,4–10,0 mg/l
Myo-inositol 100,0 mg/l
Saccharose 30,0 g/l
Agent de solidification
Gélose 8,0 g/l
3. Condition de culture
pH
Le pH du milieu est normalement ajusté entre 5,6 et 6,0 pour le meilleur résultat.
Température
Les cultures doivent être incubées normalement à température constante de 25 ° C ± 2 ° C pour une croissance optimale.
Humidité et intensité lumineuse
Les cultures nécessitent une humidité relative de 50 à 60 % et 16 heures de photopériode par l'éclairage de tubes fluorescents blanc froid d'environ 1000 lux.
Aération
L'aération de la culture peut être assurée par agitation des flacons ou tubes de culture liquide sur agitateur automatique ou aération du milieu par passage d'air stérilisé sur filtre.
4. Induction de callosités
Un explant de segment stérile de 1 à 2 cm choisi parmi une feuille, une tige, un tubercule ou une racine est inoculé (transfert des explants dans un tube en verre stérile contenant un milieu nutritif) dans le milieu nutritif MS additionné d'auxines et incubé à 25 ° C ± 2 ° C dans une période alternée de lumière et d'obscurité de 12 heures pour induire la division cellulaire et bientôt la surface supérieure de l'expiant se transforme en cal. Le cal est une masse de croissance non organisée de cellules ou de tissus végétaux dans un milieu de culture in vitro .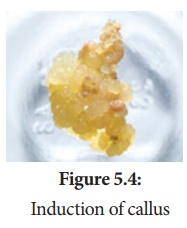
5. Embryogenèse
Les cellules calleuses subissent une différenciation et produisent des embryons somatiques, appelés Embryoïdes . Les embryoïdes sont repiqués pour produire des plantules.
6. Durcissement
Les plantules développées in vitro nécessitent une période de durcissement et sont donc transférées dans une serre ou une chambre de durcissement, puis dans des conditions environnementales normales.
L'endurcissement est l'exposition progressive des plantules développées in vitro dans des chambres humides à la lumière diffuse pour acclimatation afin de leur permettre de croître dans des conditions normales de champ.
3. Types de cultures de tissus végétaux
Sur la base des explants, d'autres types de cultures de tissus végétaux sont
1. Culture d'organes
2. Culture du méristème
3. Culture de protoplastes
4. Culture cellulaire.
1. Culture d'organes
La culture d'embryons, d'anthères, d'ovaires, de racines, de pousses ou d'autres organes de plantes sur des milieux de culture.
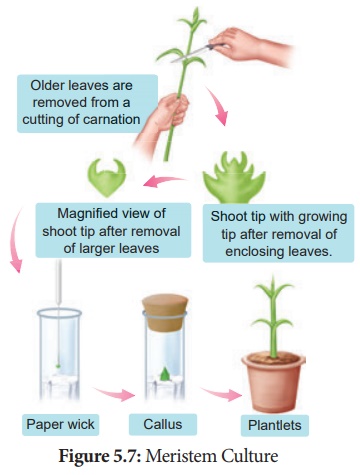
2. Culture du méristème :
La culture de tout tissu méristématique végétal sur milieu de culture.
3. Culture de protoplastes :
Les protoplastes sont des cellules sans paroi cellulaire, mais délimitées par une membrane cellulaire ou membrane plasmique. En utilisant des protoplastes, il est possible de régénérer des plantes entières à partir de cellules uniques et également de développer des hybrides somatiques. Les étapes impliquées dans la culture de protoplastes.
je. Isolement du protoplaste: De petits morceaux de tissu végétal comme le tissu foliaire sont utilisés pour l'isolement du protoplaste. Le tissu foliaire est immergé dans 0,5 % de macrozyme et 2 % d'enzymes cellulase d'Onozuka dissoutes dans 13 % de sorbitol ou de mannitol à pH 5,4. Il est ensuite incubé une nuit à 25°C. Après un taquinage doux des cellules, des protoplastes sont obtenus, et ceux-ci sont ensuite transférés dans une solution de saccharose à 20 % pour conserver leur viabilité. Ils sont ensuite centrifugés pour obtenir des protoplastes purs aussi différents que des débris de parois cellulaires.
ii. Fusion de protoplaste: Elle se fait grâce à l' utilisation d'un fusogène approprié. Il s'agit normalement de PEG (Polyéthylène Glycol). Les protoplastes isolés sont incubés dans une concentration de 25 à 30 % de PEG avec des ions Ca++ et le protoplaste présente une agglutination (la formation d'amas de cellules) et une fusion.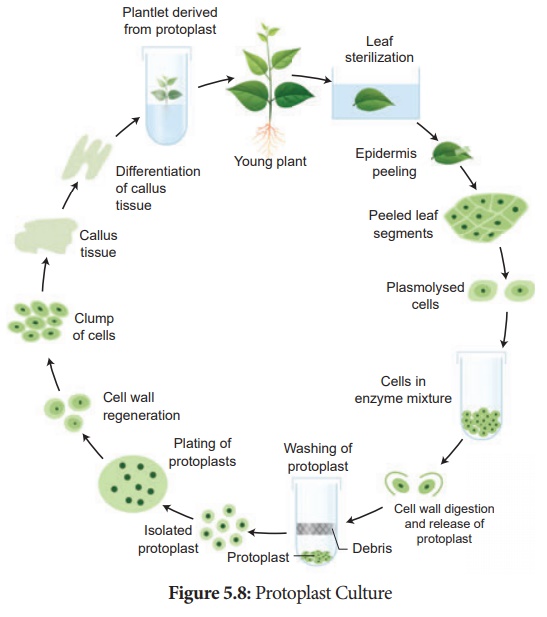
iii. Culture de protoplaste : le milieu liquide MS est utilisé avec quelques modifications dans les techniques de gouttelettes, de placage ou de micro-gouttelettes. La viabilité des protoplastes est testée avec du diacétate de fluorescéine avant la culture. Les cultures sont incubées sous une lumière continue de 1000-2000 lux à 25°C. La formation de la paroi cellulaire se produit dans les 24 à 48 heures et la première division de nouvelles cellules se produit entre 2 et 7 jours de culture.
iv. Sélection de cellules hybrides somatiques : Le produit de fusion de protoplastes sans noyau de cellules différentes est appelé un cybride. Suite à cette fusion nucléaire se produire. Ce processus est appelé hybridation somatique.
4. Culture en suspension cellulaire
La culture de cellules, y compris la culture de cellules individuelles ou de petits agrégats de cellules in vitro en milieu liquide, est connue sous le nom de culture en suspension cellulaire. La suspension cellulaire est préparée en transférant une partie du cal dans le milieu liquide et agitée à l'aide d'un agitateur rotatif. Les cellules sont séparées du tissu calleux et utilisées pour la culture en suspension cellulaire.
Production de métabolites secondaires
La culture en suspension cellulaire peut être utile pour la production de métabolites secondaires comme les alcaloïdes, les flavonoïdes, les terpénoïdes, les composés phénoliques et les protéines recombinantes. Les métabolites secondaires sont des composés chimiques qui ne sont pas nécessaires à la croissance et au développement normaux de la plante, mais qui sont produits dans la plante en tant que « sous-produits » du métabolisme cellulaire. Par exemple : biosynthèse et isolement d'alcaloïdes indoliques à partir d'une culture de cellules végétales de Catharanthus roseus.
Le processus de production de métabolites secondaires peut être étendu et automatisé à l'aide de bioréacteurs pour la production commerciale. De nombreuses stratégies telles que la biotransformation, l'élicitation et l'immobilisation ont été utilisées pour rendre les cultures en suspension cellulaire plus efficaces dans la production de métabolites secondaires. Quelques exemples de métabolites secondaires de plantes d'importance industrielle sont répertoriés ci-dessous dans le tableau :
Types de cultures de tissus végétaux
Sur la base des explants, d'autres types de cultures de tissus végétaux sont
1. Culture d'organes
2. Culture du méristème
3. Culture de protoplastes
4. Culture cellulaire.
1. Culture d'organes
La culture d'embryons, d'anthères, d'ovaires, de racines, de pousses ou d'autres organes de plantes sur des milieux de culture.
2. Culture du méristème :
La culture de tout tissu méristématique végétal sur milieu de culture.
3. Culture de protoplastes :
Les protoplastes sont des cellules sans paroi cellulaire, mais délimitées par une membrane cellulaire ou membrane plasmique. En utilisant des protoplastes, il est possible de régénérer des plantes entières à partir de cellules uniques et également de développer des hybrides somatiques. Les étapes impliquées dans la culture de protoplastes.
je. Isolement du protoplaste: De petits morceaux de tissu végétal comme le tissu foliaire sont utilisés pour l'isolement du protoplaste. Le tissu foliaire est immergé dans 0,5 % de macrozyme et 2 % d'enzymes cellulase d'Onozuka dissoutes dans 13 % de sorbitol ou de mannitol à pH 5,4. Il est ensuite incubé une nuit à 25°C. Après un taquinage doux des cellules, des protoplastes sont obtenus, et ceux-ci sont ensuite transférés dans une solution de saccharose à 20 % pour conserver leur viabilité. Ils sont ensuite centrifugés pour obtenir des protoplastes purs aussi différents que des débris de parois cellulaires.
ii. Fusion de protoplaste: Elle se fait grâce à l' utilisation d'un fusogène approprié. Il s'agit normalement de PEG (Polyéthylène Glycol). Les protoplastes isolés sont incubés dans une concentration de 25 à 30 % de PEG avec des ions Ca++ et le protoplaste présente une agglutination (la formation d'amas de cellules) et une fusion.

iii. Culture de protoplaste : le milieu liquide MS est utilisé avec quelques modifications dans les techniques de gouttelettes, de placage ou de micro-gouttelettes. La viabilité des protoplastes est testée avec du diacétate de fluorescéine avant la culture. Les cultures sont incubées sous une lumière continue de 1000-2000 lux à 25°C. La formation de la paroi cellulaire se produit dans les 24 à 48 heures et la première division de nouvelles cellules se produit entre 2 et 7 jours de culture.
iv. Sélection de cellules hybrides somatiques : Le produit de fusion de protoplastes sans noyau de cellules différentes est appelé un cybride. Suite à cette fusion nucléaire se produire. Ce processus est appelé hybridation somatique.
4. Culture en suspension cellulaire
La culture de cellules, y compris la culture de cellules individuelles ou de petits agrégats de cellules in vitro en milieu liquide, est connue sous le nom de culture en suspension cellulaire. La suspension cellulaire est préparée en transférant une partie du cal dans le milieu liquide et agitée à l'aide d'un agitateur rotatif. Les cellules sont séparées du tissu calleux et utilisées pour la culture en suspension cellulaire.
Production de métabolites secondaires
La culture en suspension cellulaire peut être utile pour la production de métabolites secondaires comme les alcaloïdes, les flavonoïdes, les terpénoïdes, les composés phénoliques et les protéines recombinantes. Les métabolites secondaires sont des composés chimiques qui ne sont pas nécessaires à la croissance et au développement normaux de la plante, mais qui sont produits dans la plante en tant que « sous-produits » du métabolisme cellulaire. Par exemple : biosynthèse et isolement d'alcaloïdes indoliques à partir d'une culture de cellules végétales de Catharanthus roseus.
Le processus de production de métabolites secondaires peut être étendu et automatisé à l'aide de bioréacteurs pour la production commerciale. De nombreuses stratégies telles que la biotransformation, l'élicitation et l'immobilisation ont été utilisées pour rendre les cultures en suspension cellulaire plus efficaces dans la production de métabolites secondaires. Quelques exemples de métabolites secondaires de plantes d'importance industrielle sont répertoriés ci-dessous dans le tableau :
Voie de régénération des plantes
A partir des explants, les plantes peuvent être régénérées par embryogenèse somatique ou organogenèse.
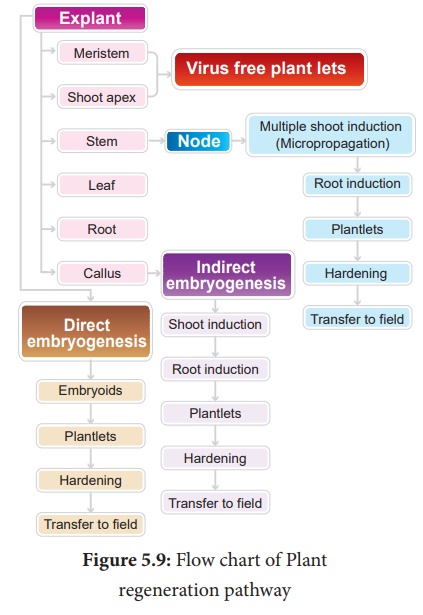
1. Embryogenèse somatique
L'embryogenèse somatique est la formation d'embryons à partir du tissu calleux directement et ces embryons sont appelés Embryoïdes ou à partir des cellules in vitro forment directement des cellules pré-embryonnaires qui se différencient en embryoïdes.
Applications
· L'embryogenèse somatique fournit des plantules potentielles qui, après une période de durcissement, peuvent s'établir en plantes.
· Les embryoïdes somatiques peuvent être utilisés pour la production de semences synthétiques.
· L'embryogenèse somatique est maintenant rapportée chez de nombreuses plantes telles que Allium sativum , Hordeum vulgare, Oryza sativa, Zea mays et ceci possible dans n'importe quelle plante.
2. Organogenèse
Les changements morphologiques se produisent dans le cal conduisant à la formation de pousses et de racines appelées organogenèse.
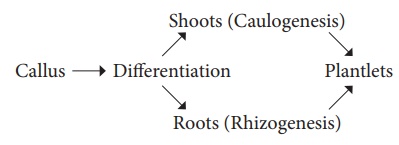
· L'organogenèse peut être induite in vitro en introduisant des régulateurs de croissance des plantes dans le milieu MS.
· L'auxine et les cytokinines induisent la formation de pousses et de racines.
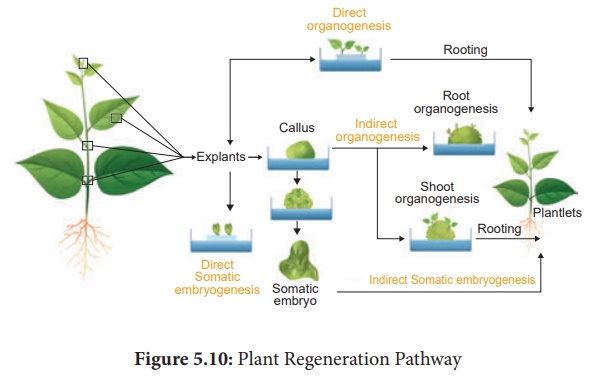
Applications de la culture de tissus végétaux
Les techniques de culture de tissus végétaux ont plusieurs applications telles que :
i. Amélioration de la production d'hybrides par hybridation somatique.
ii. Les embryoïdes somatiques peuvent être encapsulés dans des graines synthétiques (synseeds). Ces graines encapsulées ou graines synthétiques contribuent à la conservation de la biodiversité végétale.
iii. Production de plantes résistantes aux maladies grâce à la culture de méristèmes et d'apex.
iv. Production de plantes résistantes au stress comme les plantes tolérantes aux herbicides, tolérantes à la chaleur.
v. Technique de micropropagation pour obtenir un grand nombre de plantules d'espèces de cultures et d'arbres utiles en foresterie dans un court laps de temps et tout au long de l'année.
vi. Production de métabolites secondaires à partir de culture cellulaire utilisés dans les industries pharmaceutiques, cosmétiques et alimentaires.
Variations somaclonales : variations somatiques trouvées dans les plantes régénérées in vitro (c'est-à-dire variations trouvées dans la feuille, la tige, la racine, le tubercule ou la propagule)
Variations gamétoclonales : variations gamétophytiques trouvées dans les plantes régénérées d'origine gamétique in vitro (c'est-à-dire variations trouvées dans les gamètes et les gamétophytes)
1. Micropropagation du Bananier
La micropropagation de plantes au niveau industriel maintient des normes élevées d'homogénéité dans des plantes comme l'ananas, la banane, la fraise et la pomme de terre.


2. Semence artificielle
Les semences artificielles ou semences synthétiques (synseeds) sont produites à partir d'embryoïdes (embryons somatiques) obtenus par culture in vitro. Ils peuvent même être dérivés de cellules individuelles de n'importe quelle partie de la plante qui se divisent plus tard pour former une masse cellulaire contenant un cytoplasme dense, un gros noyau, des grains d'amidon, des protéines et des huiles, etc. Pour préparer les graines artificielles, différents matériaux inertes sont utilisés pour le revêtement. les embryoïdes somatiques comme l'aggrose et l'alginate de sodium.

Avantages des graines artificielles
Les graines artificielles ont de nombreux avantages par rapport aux vraies graines
· Des millions de graines artificielles peuvent être produites à tout moment à faible coût.
· Ils fournissent une méthode facile pour produire des plantes génétiquement modifiées avec des traits désirables.
· Il est facile de tester le génotype des plantes.
· Ils peuvent potentiellement être stockés pendant longtemps sous la méthode de cryoconservation.
· Les graines artificielles produisent des plantes identiques
· La période de dormance des graines artificielles est considérablement réduite, donc la croissance est plus rapide avec un cycle de vie raccourci.
3. Des plantes sans virus
Les plantes cultivées en plein champ, comme les cultures vivaces, sont généralement infectées par une variété d'agents pathogènes comme les champignons, les bactéries, les mycoplasmes, les virus qui causent des pertes économiques considérables. Les méthodes chimiques peuvent être utilisées pour contrôler les agents pathogènes fongiques et bactériens, mais pas les virus en général.
La culture de l'extrémité du méristème des pousses est la méthode pour produire des plantes exemptes de virus, car l'extrémité du méristème des pousses est toujours exempte de virus.
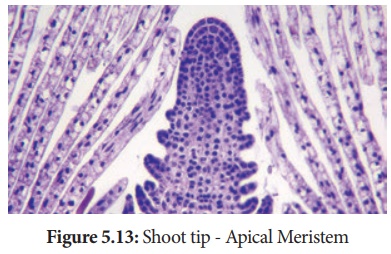

Conservation des ressources phytogénétiques
1. Conservation du matériel génétique
La conservation du germoplasme fait référence à la conservation des ressources génétiques vivantes telles que le pollen, les graines ou les tissus de matériel végétal conservés à des fins de sélection végétale sélective, de conservation en condition vivante et utilisés pour de nombreux travaux de recherche.

Les ressources de conservation du matériel génétique font partie de la collecte de graines et de pollen qui sont stockées dans des banques de graines ou de pollen, afin de maintenir leur viabilité et leur fertilité pour toute utilisation ultérieure telle que l'hybridation et l'amélioration des cultures.
La conservation du matériel génétique peut également impliquer une banque de gènes, une banque d'ADN de lignées génétiques d'élite de ressources végétales pour le maintien de la diversité biologique et aussi pour la sécurité alimentaire.
2. Cryoconservation (–195.C)
La cryoconservation, également connue sous le nom de Cryo-conservation, est un processus par lequel des protoplastes, des cellules, des tissus, des organites, des organes, Figure 5.16 : Cryoconservation de la matrice extracellulaire, des enzymes ou de tout autre matériel biologique sont soumis à une conservation par refroidissement à très basse température de –196 ° C à l'aide d'azote liquide. A cette température extrêmement basse, toute activité enzymatique ou chimique du matériel biologique sera totalement stoppée, ce qui conduit à la conservation du matériel à l'état dormant. Plus tard, ces matériaux peuvent être activés en les portant lentement à température ambiante pour tout travail expérimental.

Des agents protecteurs comme le diméthylsulfoxyde, le glycérol ou le saccharose sont ajoutés avant le processus de cryoconservation. Ces agents protecteurs sont appelés cryoprotecteurs, car ils protègent les cellules ou les tissus du stress de la température de congélation.
Droit de propriété intellectuelle (DPI)
Le droit de propriété intellectuelle (DPI) est une catégorie de propriété qui comprend la création immatérielle de l'intellect humain et se compose principalement de droits d'auteur, de brevets et de marques. Il comprend également d'autres types de droits, tels que les secrets commerciaux, les droits de publicité, les droits moraux et les droits contre la concurrence déloyale.
· En biotechnologie, les micro-organismes et plantes transformés et les technologies pour la production de produits commerciaux sont la propriété exclusive du découvreur.
· Le découvreur a tous les droits sur sa propriété. Il ne doit pas être négligé par les autres sans autorisation légale.
· Le droit de découvreur doit être protégé et il le fait par certaines lois encadrées par un pays.
· Les droits de propriété intellectuelle sont protégés par différents moyens tels que les brevets, les droits d'auteur, les secrets commerciaux et les marques, les dessins et les indications géographiques.

1. Brevets
· Il s'agit d'un droit spécial au découvreur/inventeur qui a été accordé par le gouvernement par le biais de la législation pour le commerce de nouveaux articles.
· Un brevet est une propriété personnelle qui peut être concédée sous licence ou vendue par la personne ou l'organisation comme n'importe quelle autre propriété.
· Les termes du brevet donnent à l'inventeur le droit d'empêcher les autres de fabriquer, d'utiliser ou de vendre son invention.
· Il est difficile de garder secrètes certaines inventions et, par conséquent, des conseils doivent être obtenus auprès d'un conseil en brevets qualifié.
· Un brevet se compose de trois parties : la délivrance, les spécifications et les revendications.
· La délivrance est remplie à l'office des brevets qui n'est pas publié. C'est un document signé, en fait l'accord qui accorde le droit de brevet à l'inventeur.
· La description et les revendications sont publiées sous la forme d'un document unique rendu public par l'office des brevets. La partie spécification est narrative dans laquelle l'objet de l'invention est décrit comme la manière dont l'invention a été réalisée.
· La revendication définit précisément la portée de l'invention à protéger par le brevet que les autres ne peuvent pratiquer.
Étapes générales du brevetage
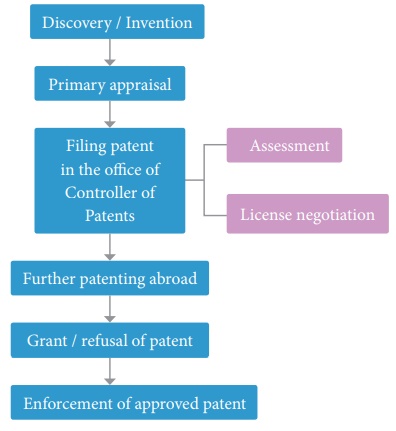
2. Biosécurité et bioéthique
Les progrès de la biotechnologie et leurs applications sont le plus souvent associés à des controverses. C'est parce que la majeure partie de la biotechnologie moderne traite des manipulations génétiques. ELSI qui représente les implications éthiques , juridiques et sociales de la biotechnologie couvre largement la relation entre la biotechnologie et la société avec une référence particulière aux aspects éthiques et juridiques.
Biosécurité
La biosécurité est la prévention de la perte à grande échelle de l'intégrité biologique, axée à la fois sur l'écologie et la santé humaine. Ces mécanismes de prévention comprennent la réalisation d'examens réguliers de la biosécurité en laboratoire, ainsi que des directives strictes à suivre. La biosécurité est utilisée pour se protéger des incidents nuisibles. De nombreux laboratoires manipulant des risques biologiques utilisent un processus continu d'évaluation et d'application de la gestion des risques pour la biosécurité. Le non-respect de ces protocoles peut entraîner un risque accru d'exposition à des risques biologiques ou à des agents pathogènes. L'erreur humaine et les mauvaises techniques contribuent à une exposition inutile aux dangers et compromettent les meilleures garanties mises en place pour la protection.
Risques potentiels et prise en compte des aspects de sécurité
· Pathogénicité des organismes vivants et des virus - naturels et génétiquement modifiés - pour infecter les humains, les animaux et les plantes et provoquer des maladies.
· Toxicité de l'allergie associée à la production microbienne.
· Augmentation du nombre de micro-organismes pathogènes résistants aux antibiotiques.
· Problèmes associés à l'élimination de la biomasse microbienne usée et à la purification des effluents des procédés biotechnologiques.
· Aspects de sécurité liés à la contamination, à l'infection ou à la mutation des souches de procédé.
· Aspects de sécurité liés à l'utilisation industrielle de micro-organismes contenant des recombinants in vitro .
Les directives de biosécurité sont mises en œuvre par :
· Les Comités Institutionnels de Biosécurité (IBSC) surveillent l'activité de recherche au niveau institutionnel.
· Le Comité d'examen des manipulations génétiques (RCGM) fonctionnant au sein du Département de biotechnologie (DBT) surveille les activités de recherche à risque dans les laboratoires.
· Le Comité d'approbation du génie génétique (GEAC) du Ministère de l'environnement et des forêts a le pouvoir d'autoriser l'utilisation d'organismes génétiquement modifiés (OGM) au niveau commercial et des essais en plein champ de matériaux transgéniques, y compris les cultures agricoles, les produits industriels et les produits de soins de santé.
Bioéthique - Implications éthiques, juridiques et sociales (ELSI)
La bioéthique fait référence à l'étude des questions éthiques découlant des progrès de la biologie et de la médecine. C'est aussi un discernement moral en ce qui concerne la politique et la pratique médicales. Les bioéthiciens s'intéressent aux questions éthiques qui se posent dans les relations entre
sciences de la vie, biotechnologie et médecine. Il comprend l'étude des valeurs relatives aux soins primaires et à d'autres branches de la médecine.
La portée de la bioéthique est directement liée à la biotechnologie, y compris le clonage, la thérapie génique, la prolongation de la vie, le génie génétique humain, la vie astroéthique dans l'espace et la manipulation de la biologie de base par l'altération de l'ADN, de l'ARN et des protéines. Ces développements de la biotechnologie affecteront l'évolution future et pourraient nécessiter de nouveaux principes, tels que l'éthique biotique, qui valorisent la vie et ses caractéristiques et structures biologiques de base.
Le programme Ethical, Legal, and Social Implications (ELSI) a été fondé en 1990 en tant que partie intégrante du Human Genome Project. La mission du programme ELSI était d'identifier et de résoudre les problèmes soulevés par la recherche génomique qui affecteraient les individus, les familles et la société. Un pourcentage du budget du Human Genome Project des National Institutes of Health et du US Department of Energy a été consacré à la recherche ELSI.
Questions éthiques dans la recherche génomique
· Confidentialité et équité dans l'utilisation des informations génétiques, y compris le potentiel de discrimination génétique dans l'emploi et l'assurance.
· L'intégration de nouvelles technologies génétiques, telles que les tests génétiques, dans la pratique de la médecine clinique.
· Les questions éthiques entourant la conception et la conduite de la recherche génétique avec des personnes, y compris le processus de consentement éclairé.
Comité d'évaluation du génie génétique (GEAC)
Le GEAC est un organisme faîtier relevant du ministère de l'Environnement, des Forêts et du Changement climatique chargé de réglementer la fabrication, l'utilisation, l'importation, l'exportation et le stockage de microbes dangereux ou d'organismes génétiquement modifiés (OGM) et de cellules dans le pays. Il a été créé en tant qu'organe suprême pour accorder l'approbation des activités impliquant l'utilisation à grande échelle de micro-organismes dangereux et de recombinants dans la recherche et la production industrielle. Le GEAC est également responsable de l'approbation des propositions relatives à la dissémination d'organismes et de produits génétiquement modifiés dans l'environnement, y compris les essais expérimentaux sur le terrain (Biosafety Research Level trial-I et II connus sous le nom de BRL-I et BRL-II).
Avenir de la biotechnologie
La biotechnologie est devenue une entreprise scientifique complète du point de vue académique et commercial, en peu de temps avec le séquençage du génome humain et du génome de certains organismes importants. Les développements futurs de la biotechnologie seront passionnants. Ainsi, le développement de la biotechnologie conduira à une nouvelle révolution scientifique qui changera la vie et l'avenir des gens. Comme la révolution industrielle et informatique, la révolution biotechnologique promettra également des changements majeurs dans de nombreux aspects de la vie moderne.
Culture de tissus végétaux (PTC) : résumé
La culture tissulaire est la culture aseptique in vitro de cellules, de tissus ou d'organes dans des plantes entières dans des conditions nutritionnelles et environnementales contrôlées. Un physiologiste allemand Gotllieb Haberlant en 1902 a tenté pour la première fois de cultiver des cellules végétales dans un milieu artificiel, il était donc considéré comme le père de la culture tissulaire. Culture tissulaire principalement basée sur les concepts de totipotence, différenciation, redifférenciation et dédifférenciation. La technique de culture de tissus végétaux implique la sélection d'explants, la stérilisation, la préparation des milieux, le maintien des conditions de culture, la formation de cals, l'embryogenèse ou l'organgenèse et le durcissement. Sur la base des explants choisis, les types de culture tissulaire sont la culture d'organes, la culture de méristèmes, la culture de protoplastes et la culture en suspension cellulaire. A partir des explants, les plantes peuvent être régénérées par embryogenèse somatique ou l'organgenèse est dite voie de régénération des plantes. Certaines des principales applications de la culture tissulaire sont la production d'hybrides somatiques, de semences artificielles, de plantes résistantes aux maladies et au stress, la conservation du germoplasme, la micropropagation et la production de métabolites secondaires. Le droit de propriété intellectuelle (DPI) vise principalement les brevets, les droits d'auteur, les secrets commerciaux et les marques de commerce accordés au découvreur/inventeur pour la production commerciale de micro-organismes ou de plantes transformés. La biosécurité est le mécanisme de prévention visant à protéger les incidents nuisibles dus à des risques biologiques ou à des agents pathogènes. La bioéthique traitait des questions éthiques découlant des progrès biotechnologiques. Le programme ELSI aborde les questions liées à la recherche génomique.
Glossaire
Condition aseptique : Préparation de matériaux exempts de microbes dans des cultures in vitro.
Culture cellulaire : culture de cellules in vitro, y compris la culture de cellules individuelles ou de petits agrégats de cellules dans un milieu liquide.
Milieu chimiquement défini : milieu nutritif utilisé pour la culture de cellules ou de tissus ; chaque produit chimique de ce milieu est connu et défini ;
Cybride : Hybride cytoplasmique obtenu par la fusion de cytoplasme de cellules de différentes sources parentales ; terme appliqué à la fusion de cytoplasmes de deux protoplastes différents ;
Organogenèse : processus d'initiation et de développement de pousses ou de racines par culture in vitro, en particulier à partir de cals
Évaluation
Choisissez la bonne réponse parmi l'option proposée :
1. La totipotence fait référence à
a) capacité à générer des plantes génétiquement identiques.
b) capacité à générer une plante entière à partir de n'importe quelle cellule végétale / explant.
c) capacité à générer des protoplastes hybrides.
d) récupération de plantes saines à partir de plantes malades.
2. La micropropagation implique
a) multiplication végétative de plantes à l'aide de micro-organismes.
b) multiplication végétative des plantes en utilisant de petits explants.
c) multiplication végétative de plantes en utilisant des microspores.
d) Multiplication non végétative de plantes en utilisant des microspores et des mégaspores.
3. Associez les éléments suivants :
Colonne A :
1) Totipotence
2) Dédifférenciation
3) Explantation
4) Différenciation
Colonne B :
A) Réversion des cellules matures en méristème
B) Modifications biochimiques et structurelles des cellules
C) Les propriétés des cellules vivantes se développent dans la plante entière
D) Tissu végétal sélectionné transféré dans un milieu de culture
1 2 3 4
a) c1:C, c2:A, c3:D, c4:B
b) c1:A, c2:C, c3:B, c4:D
c) c1:B, c2:A, c3:D, c4:C
d) c1:D, c2:B, c3:C, c4:A
4. La durée du processus de stérilisation à l'aide d'un autoclave est de ______ minutes et la température est de _______
a) 10 à 30 minutes et 125°C
b) 15 à 30 minutes et 121°C
c) 15 à 20 minutes et 125°C
d) 10 à 20 minutes et 121°C
5. Laquelle des affirmations suivantes est correcte
a) L'agar n'est pas extrait d'algues marines telles que les algues.
b) Le cal subit une différenciation et produit des embryoïdes somatiques.
c) La stérilisation de surface des explants se fait à l'aide de bromure mercurique
d) Le pH du milieu de culture est de 5,0 à 6,0
6. Sélectionnez la déclaration incorrecte de la déclaration donnée
a) Un tonique utilisé pour l'arrêt cardiaque est obtenu à partir de Digitalis purpuria
b) Le médicament utilisé pour traiter les douleurs rhumatismales est extrait du Capsicum annum
c) Un médicament antipaludéen est isolé de Cinchona officinalis.
d) La propriété anti-cancérigène n'est pas observée chez Catharanthus roseus.
7. Des plantes exemptes de virus sont développées à partir
a) Culture d'organes
b) Culture de méristèmes
c) Culture de protoplastes
d) Culture en suspension cellulaire
8. La prévention de la perte à grande échelle de l'interité biologique
a) Biobrevet
b) Bioéthique
c) Biosécurité
d) Biocarburant
9. La cryoconservation signifie qu'il s'agit d'un processus de préservation des cellules, tissus ou organes végétaux
a) à très basse température en utilisant de l'éther.
b) à très haute température en utilisant de l'azote liquide
c) à très basse température de -196 en utilisant de l'azote liquide
d) à très basse température en utilisant de l'azote liquide
10. L'agent de solidification utilisé dans la culture de tissus végétaux est
a) Acide nicotinique
b) Chlorure de cobalt
c) EDTA
d) Gélose
Répondre aux questions suivantes
11. Quel est le nom du processus donné ci-dessous ? Écris ses 4 types.
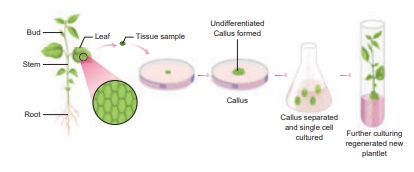
Réponse : Le processus est la culture de tissus végétaux. Sur la base des explants, la culture de tissus végétaux est classée comme :
(i) Culture d'organes
(ii) Culture de méristèmes
(iii) Culture de protoplastes
(iv) Culture cellulaire.
12. Comment allez-vous éviter la croissance de microbes dans un milieu nutritif pendant le processus de culture ? Quelles sont les techniques utilisées pour éliminer les microbes ?
Réponse : La stérilisation est la technique utilisée pour se débarrasser des microbes tels que les bactéries et les champignons dans le milieu de culture, les récipients et les explants.
(i) Maintien de l'environnement aseptique : pendant la culture de tissus in vitro, le maintien des conditions environnementales aseptiques doit être suivi, c'est-à-dire la stérilisation de la verrerie, des pinces, des scalpels et de tous les accessoires dans la stérilisation à la vapeur humide par autoclavage à 15 psi (121 °C) pendant 15 à 30 minutes ou trempage dans de l'éthanol à 70 % suivi d'un flambage et d'un refroidissement.
(ii) Stérilisation des milieux nutritifs :
(a) Les milieux de culture sont distribués dans des récipients en verre, bouchés avec du coton non absorbant ou scellés avec des fermetures en plastique, puis stérilisés à l'aide d'un autoclave à 15 psi (121 ° C) pendant 15 à 30 minutes.
(b) Les extraits de plantes, les vitamines, les acides aminés et les hormones sont stérilisés en passant à travers un filtre Millipore avec un diamètre de pores de 0,2 mm, puis ajoutés au milieu de culture stérilisé à l'intérieur de la chambre à flux d'air laminaire dans des conditions stériles.
13. Écrivez les différentes étapes de la culture en suspension cellulaire.
Réponse : Culture en suspension cellulaire :
(i) La culture de cellules, y compris la culture de cellules individuelles ou de petits agrégats de cellules in vitro dans un milieu liquide, est connue sous le nom de culture en suspension cellulaire.
(ii) La suspension cellulaire est préparée en transférant une partie du cal dans le milieu liquide et agitée à l'aide d'un agitateur rotatif.
(iii) Les cellules sont séparées du tissu calleux et utilisées pour la culture en suspension cellulaire.
Production de métabolites secondaires :
(i) La culture en suspension cellulaire peut être utile pour la production de métabolites secondaires comme les alcaloïdes, les flavonoïdes, les terpénoïdes, les composés phénoliques et les protéines recombinantes.
(ii) Les métabolites secondaires sont des composés chimiques qui ne sont pas nécessaires à la croissance et au développement normaux de la plante, mais qui sont produits dans la plante en tant que « sous-produits » du métabolisme cellulaire.
Par exemple : biosynthèse et isolement d'alcaloïdes indoliques à partir d'une culture de cellules végétales de Catharanthus roseus .
(iii) Le processus de production de métabolites secondaires peut être étendu et automatisé à l'aide de bioréacteurs pour la production commerciale.
(iv) De nombreuses stratégies telles que la biotransformation, l'élicitation et l'immobilisation ont été utilisées pour rendre les cultures en suspension cellulaire plus efficaces dans la production de métabolites secondaires.
14. Qu'entendez-vous par Embryoïdes ? Écrivez son application.
Réponse : L'embryogenèse somatique est la formation d'embryons à partir du tissu calleux directement et ces embryons sont appelés Embryoïdes ou à partir des cellules in vitro forment directement des cellules pré-embryonnaires qui se différencient en embryoïdes.
Applications:
(i) L'embryogenèse somatique fournit des plantules potentielles qui, après une période de durcissement, peuvent s'établir en plantes.
(ii) Les embryoïdes somatiques peuvent être utilisés pour la production de semences synthétiques.
(iii) L'embryogenèse somatique est maintenant rapportée dans de nombreuses plantes telles que Allium sativum , Hordeum vulgare , etc. et cela est possible dans n'importe quelle plante.
15. Donnez des exemples de plantes réalisées en micro propagation.
Réponse : La micropropagation de plantes au niveau industriel maintient des normes élevées d'homogénéité dans des plantes comme l'ananas, la banane, la fraise et la pomme de terre.
16. Expliquer les concepts de base impliqués dans la culture de tissus végétaux.
Réponse : Les concepts de base de la culture de tissus végétaux sont la totipotence, la différenciation, la dédifférenciation et la redifférenciation.
Totipotence :
Propriété des cellules végétales vivantes d'avoir le potentiel génétique lorsqu'elles sont cultivées dans un milieu nutritif pour donner naissance à une plante individuelle complète.
Différenciation:
Le processus de changements biochimiques et structurels par lequel les cellules se spécialisent dans la forme et la fonction.
Redifférenciation :
La différenciation ultérieure d'une cellule déjà différenciée en un autre type de cellule. Par exemple, lorsque les cellules constitutives du cal ont la capacité de former une plante entière dans un milieu nutritif, le phénomène est appelé redifférenciation.
Dédifférenciation :
Le phénomène de retour des cellules matures à l'état méristématique conduisant à la formation de cals est appelé dédifférenciation. Ces deux phénomènes de redifférenciation et de dédifférenciation sont les capacités inhérentes aux cellules ou tissus végétaux vivants. C'est ce qu'on appelle la totipotence.
17. En fonction du matériel utilisé, comment allez-vous classer la technologie de culture ? Explique le.
Réponse : Sur la base des explants, d'autres types de cultures de tissus végétaux sont
(a) Culture d'organes
(b) Culture de méristèmes
(c) Culture de protoplastes
(d) Culture cellulaire
(a) Culture d'organes :
La culture d'embryons, d'anthères, d'ovaires, de racines, de pousses ou d'autres organes de plantes sur des milieux de culture.
(b) Culture de méristème :
La culture de tout tissu méristématique végétal sur milieu de culture.
(c) Culture de protoplastes :
Les protoplastes sont des cellules sans paroi cellulaire, mais délimitées par une membrane cellulaire ou membrane plasmique. En utilisant des protoplastes, il est possible de régénérer des plantes entières à partir de cellules uniques et également de développer des hybrides somatiques.
(d) Culture en suspension cellulaire :
La culture de cellules, y compris la culture de cellules individuelles ou de petits agrégats de cellules in vitro en milieu liquide, est connue sous le nom de culture en suspension cellulaire. La suspension cellulaire est préparée en transférant une partie du cal dans le milieu liquide et agitée à l'aide d'un agitateur rotatif. Les cellules sont séparées du tissu calleux et utilisées pour la culture en suspension cellulaire.
18. Donnez un compte rendu sur la cryoconservation.
Réponse : Cryoconservation :
(i) La cryoconservation, également appelée cryo-conservation , est un processus par lequel des protoplastes, des cellules, des tissus, des organites, des organes, une matrice extracellulaire, des enzymes ou tout autre matériel biologique sont soumis à une conservation par refroidissement à très basse température de -196° C à l'aide d'azote liquide.
(ii) A cette température extrêmement basse, toute activité enzymatique ou chimique du matériel biologique sera totalement arrêtée, ce qui conduit à la conservation du matériel à l'état dormant.
(iii) Plus tard, ces matériaux peuvent être activés en les portant lentement à température ambiante pour tout travail expérimental.
(iv) Des agents protecteurs tels que le diméthylsulfoxyde, le glycérol ou le saccharose sont ajoutés avant le processus de cryoconservation. Ces agents protecteurs sont appelés cryoprotecteurs, car ils protègent les cellules ou les tissus du stress de la température de congélation.
19. Que savez-vous de la conservation du matériel génétique. Décris le.
Réponse : Conservation du germoplasme :
(i) La conservation du germoplasme fait référence à la conservation des ressources génétiques vivantes telles que le pollen, les graines ou les tissus de matériel végétal conservés à des fins de sélection végétale sélective, de conservation en conditions vivantes et utilisés pour de nombreux travaux de recherche.
(ii) Les ressources de conservation du matériel génétique font partie de la collecte de semences et de pollen qui sont stockées dans des banques de semences ou de pollen, afin de maintenir leur viabilité et leur fertilité pour toute utilisation ultérieure telle que l'hybridation et l'amélioration des cultures.
(iii) La conservation du matériel génétique peut également impliquer une banque de gènes, une banque d'ADN de lignées génétiques d'élite de ressources végétales pour le maintien de la diversité biologique et aussi pour la sécurité alimentaire.
20. Rédigez le protocole de préparation des semences artificielles.
Réponse : Protocole de préparation des semences artificielles :
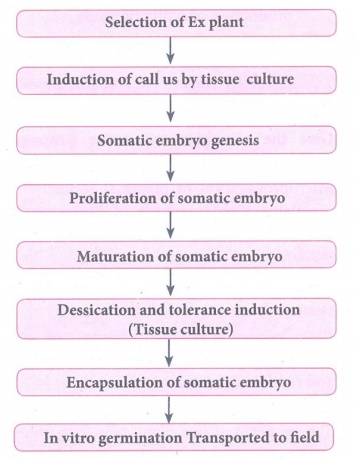
Sélection de l'usine Ex
↓
Induction de call us par culture tissulaire
↓
Genèse de l'embryon somatique
↓
Prolifération d'embryon somatique
↓
Maturation de l'embryon somatique
↓
Induction de la dessiccation et de la tolérance (Culture tissulaire)
↓
Encapsulation d'embryon somatique
↓
Germination in vitro Transporté au champ
Glossaire
Condition aseptique : Préparation de matériaux exempts de microbes dans des cultures in vitro.
Culture cellulaire : culture de cellules in vitro, y compris la culture de cellules individuelles ou de petits agrégats de cellules dans un milieu liquide.
Milieu chimiquement défini : milieu nutritif utilisé pour la culture de cellules ou de tissus ; chaque produit chimique de ce milieu est connu et défini ;
Cybride : Hybride cytoplasmique obtenu par la fusion de cytoplasme de cellules de différentes sources parentales ; terme appliqué à la fusion de cytoplasmes de deux protoplastes différents ;
Organogenèse : processus d'initiation et de développement de pousses ou de racines par culture in vitro, en particulier à partir de cals







